
-
판교 사업장
경기도 성남시 분당구 판교로 255 이노밸리F동 7층
-
오송 사업장
충청북도 청주시 흥덕구 오송읍 오송생명4로 168-23
-
제천 사업장
충청북도 제천시 바이오밸리3로 30
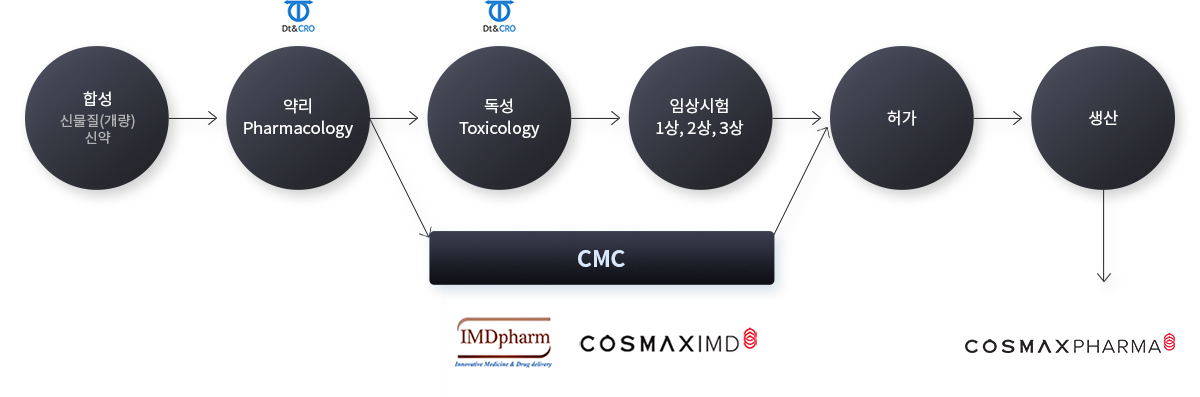
연구개발
임상약의 CMC Chemistry, Manufacturing & Control
제형/제제 설계, 위탁 제조, 기준및시험방법, 안정성(품질 평가)
자세한 내용은 CosmaxIMD 홈페이지를 참고하세요.

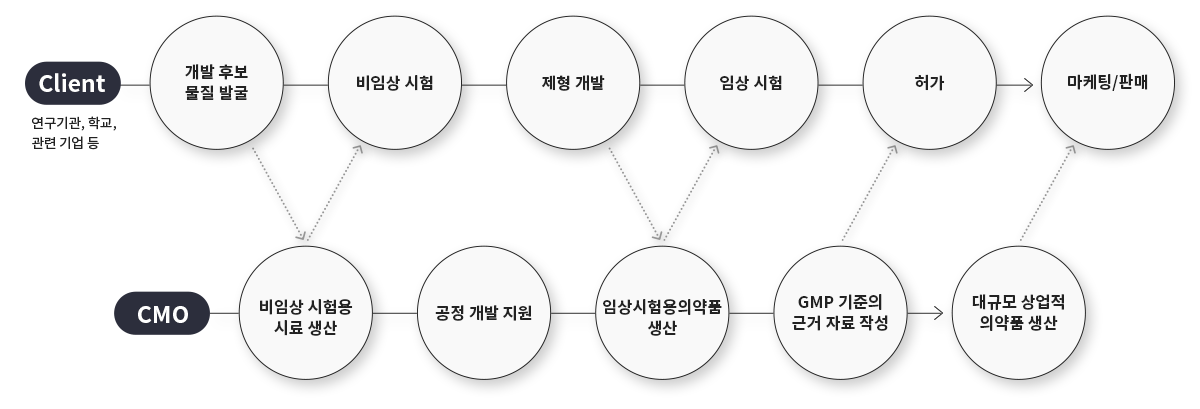
CMO 사업의 업무 프로세스 및 주요 활동
출처 : Patheon, LG경제연구원, (주)에프디메이트 재가공
-
비임상 시험용 시료 생산
Pilot scale
-
공정 개발 지원
공정 및 분석법 개발
-
임상용 의약품 생산
최적화 공정 설계 및 SOP(Standard Operating Procedure) 작성, 소규모 Sample 생산
-
GMP 기준의 근거 자료 작성
GMP 기준에 부합하는 품질 매뉴얼 작성, 시설 및 장비 등의 시스템 구축, 품목별 밸리데이션 보고서 작성과 제출
-
대규모 상업적 의약품 생산
완제의약품의 대규모 생산, 포장 및 품질 관리
CMO의 업무 내용
| 업무영역 | 주요내용 |
|---|---|
| 위탁생산 |
- 임상시험의약품(Investigational Product)생산 - Pilot scale 생산 - Pivotal scale 생산 |
| 생산 공정 & 기준 및 시험법개발확인 |
- 제품별 생산 공정 확립 - In process control 확립 - 품질관리 QC 시험항목 개발 - 품질관리 QC 시험법 개발 - 품질보증 process확립 - 품질보증 documentation 확립 - 제품 시험 validation 자료 확보 - 원료 시험 validation 자료 확보 |
| 제품제형 개발 |
- 개발제품의 적합한 제형 연구 - 개발된 제형에 대한 안정성시험 자료 확보 |
| 해외등록서류개발 |
- 수출국에 대한 제품 QC/QA 서류작성 - 수출국요구에 맞는 Inspection준비 및 서류작성 |
| 신약 벤처 생산 서비스 |
- 개발제품의 Pilot scale 공정개발 - 지표물질의 확인 및 분석시험법 개발 |
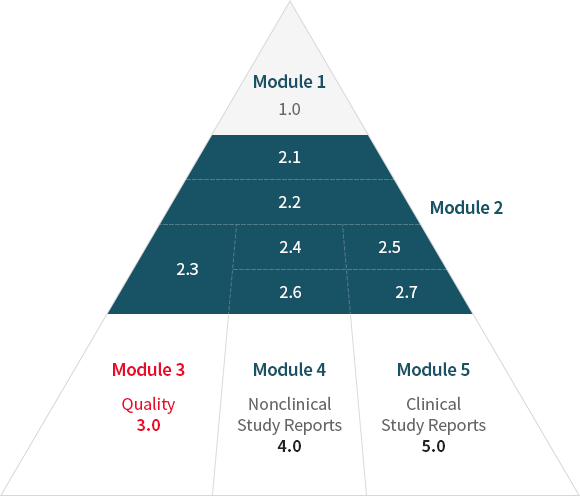
CTD 구성 모식도 module 3 포함
| Module 3 | |
|---|---|
| 3.1 | MODULE 3 TABLE OF CONTENTS |
| 3.2 | BODY OF DATA |
| 3.2.S | DRUG SUBSTANCE |
| 3.2.S.1 | General Information |
| 3.2.S.2 | Manufacture |
| 3.2.S.3 | Characterisation |
| 3.2.S.4 | Control of Drug Substance |
| 3.2.S.5 | Reference Standards or Materials |
| 3.2.S.6 | Container Closure System |
| 3.2.S.7 | Stability |
| 3.2.P | DRUG PRODUCT |
| 3.2.P.1 | Description and Composition of the Drug Product |
| 3.2.P.2 | Pharmaceutical Development |
| 3.2.P.3 | Manufacture |
| 3.2.P.4 | Control of Excipients |
| 3.2.P.5 | Control of Drug Product |
| 3.2.P.6 | Reference Standards or Materials |
| 3.2.P.7 | Container Closure System |
| 3.2.P.8 | Stability |
CMC service 범위 IDN용
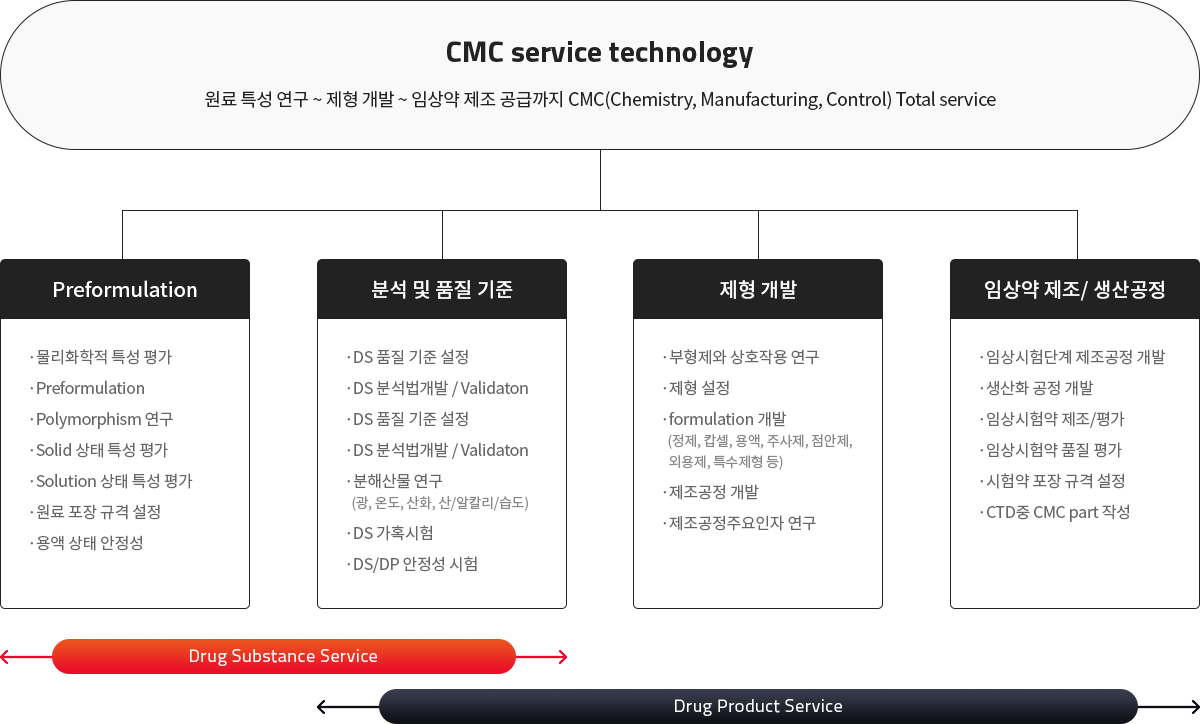
Drug Substance
| 항목 | 구체적 항목 | 서비스 가능여부 | 비고 | |
|---|---|---|---|---|
| 1 |
원료 합성 연구 |
▲ |
||
| 2 |
원료 특성 및 Preformulation 연구 Physicochemical Properties |
1) 원료 물리화학적 특성연구 1) 성상, 2) Melting Point, 3) 열역학적 특성 (DSC, TGA), 4) 흡습성(Hygroscopicity), 5) Partition Coefficient (Log P), 6) 선광성, 7) Particle size, 8) 수분함량(water content) & 건조감량, 9) 강열잔분, 10) Bulk density & Tapped density, 12) 비표면적 - Solution 상태 1) Water solubility, 2) pH solution solubility, 3) Solvent solubility (PG, PEG, Alcohol,…), 4) Dissociation constant (pKa), 5) Drug solution pH - 용액내 안정성 |
● |
1.2 |
|
2) 결정성 연구 Polymorphism |
● |
|||
|
3) 체내흡수/용출 특성 연구 |
● |
|||
|
4) 가용화 연구Intrinsic Dissolution (properties) |
● |
|||
| 3 |
원료 안정성 평가 Chemical stability
1) pH solution stability |
1) DS_장기 안정성 평가 |
● |
0.3 |
|
2) DS_가속 안정성 평가 |
● |
|||
|
3) DS_포장규격 설정 |
● |
|||
| 4 |
원료 분해산물 평가 연구 Degradation test
1) Photo degradation |
1) 가혹조건 안정성평가 |
● |
0.5 |
|
2) 가혹조건 원료 분해산물 생성 연구 |
● |
|||
|
3) 원료의 분해조건 연구 |
● |
|||
| 5 |
품질기준 설정 평가 |
1) 품질 기준 항목 설정 |
● |
0.4 |
|
2) 품질 기준 설정 연구 |
● |
|||
| 6 |
시험법 설정 및 Validation 1) 함량, 2) 유연물질 |
1) 품질항목 시험법 확립 |
● |
|
|
2) 분석법 Validation |
● |
|||
| 7 |
DS part(3.1) CTD 작성 |
IND 신청 CTD 작성 |
● |
Drug Product
| 항목 | 구체적 항목 | 서비스 가능여부 | 비고 | |
|---|---|---|---|---|
| 1 |
제형 개발 제형 개발 Oral (solution, capsule, tablet), Parenteral (IV, IM & SC, 동결건조), Ophthalmic (eye drop solution), skin (cream, ointment, lotion), special formulation (nanoparticle, liposome…) |
1) 제형개발 전략 수립 |
● |
1.5 |
|
2) 임상제형 용량 설계 |
● |
|||
|
3) 부형제 배합적합성 연구 |
● |
|||
|
4) 개발 제형 |
● |
|||
| 2 |
제조공정 확립 및 공정 변수 연구
1) Process development |
1) 제조 공정 확립 |
● |
|
|
2) 제조기술이전 |
● |
|||
|
3) 주요공정 변수 설정 |
● |
|||
|
4) QbD 설계 및 자문) |
● |
|||
| 3 |
제형 안정성 평가 |
1) DP_장기안정성 평가 |
● |
0.6 |
|
2) DP_가속안정성 평가 |
● |
|||
|
3) DP_포장규격 설정 |
● |
|||
| 4 |
제형 가혹시험 연구
1) Temperature condition |
DP_가혹시험 |
● |
0.6 |
| 5 |
품질기준 설정 평가 |
1) 품질 기준 항목 설정 |
● |
0.5 |
|
2) 품질 기준 설정 연구 |
● |
|||
| 6 |
시험법 설정 및 Validation
1) 함량시험법 |
1) 품질항목 시험법 확립 |
● |
|
|
2) 분석법 Validation |
● |
|||
| 7 |
임상시험약 제조(고형제) |
1) GMP 시설에서 제조 |
● |
·1회 생산 +원료성적서 + 완제성적서 ·3년 안정성: 1번 * 12번 ·ND: 1 batch (lab 2 batch), NDA: 3 batch 실생산 ·Total: 1회 당 3용량 생산 * 안정성 ·1상 생산 + 2상 생산 |
|
2) 임상시험약 포장/관리 |
● |
|||
|
3) 임상약 안정성 평가 |
● |
|||
| 8 |
DS part(3.1) CTD 작성 |
IND 신청 CTD 작성 |
● |
Preclinical Formulation
| 연구항목 | 비고 | |
|---|---|---|
| F. Vehicle study |
1. Solubilization test |
Total 0.4/0.5 |
|
2. Vehicle stability |
||
|
3. Preclinical formulation |
임상시험용의약품 제조소(GMP)













